商品详情
返回产品目录商品包装及说明书因厂家更换频繁,如有不符以实物为主
夫曲赛仑注射液(皮下给药)
国际零售参考价:¥**/盒
产品参数 中文说明 外文说明关联产品 本品资讯
-
- 通用名称
- 夫曲赛仑注射液(皮下给药)
- 商品名
- Amvuttra
- 英文名称
- vutrisiran
- 包装规格
- 25mg/0.5ml
- 关键词
- 多发性神经病
- 产地及厂家
- 美国Alnylam
- 适应症范围
- 用于治疗成人遗传性转甲状腺素蛋白淀粉样变的多发性神经病
- 其它说明
- 可以预订
-
温馨提醒:本说明书仅供参考,最新的说明书详见药品附带的说明书。
完整的处方信息
1 适应症及用法
AMVUTTRA 适用于治疗成人遗传性转甲状腺素蛋白介导的淀粉样变性的多发性神经病。
2 用法用量
2.1 推荐剂量
AMVUTTRA 的推荐剂量是每 3 个月一次通过皮下注射给药 25 mg [见剂量和给药方法 (2.2) ]。
错过剂量
如果错过剂量,请尽快服用 AMVUTTRA。从最近给药的剂量开始每 3 个月恢复给药。
2.2 管理说明
AMVUTTRA 仅供皮下使用,应由医疗保健专业人员管理。
注射器使用前后的外观
使用前
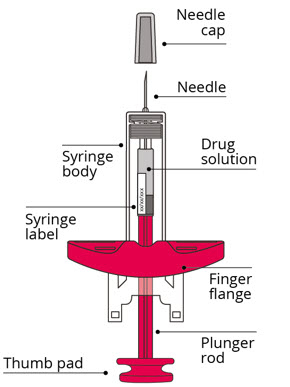
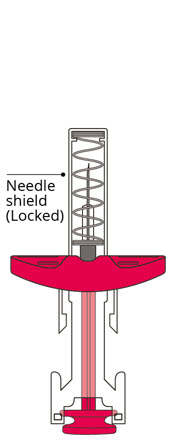
使用后
准备和管理
1.准备注射器
如果冷藏保存,使用前让注射器升温至室温 30 分钟。
握住注射器主体,从包装中取出注射器。
在准备好注射之前不要触摸柱塞杆。
给药前目视检查药物溶液的变色和颗粒物质。AMVUTTRA 是一种无菌、无防腐剂、透明、无色至黄色的溶液。如果它含有颗粒物或混浊或变色,请勿使用。
检查以下内容:
- 注射器没有损坏,例如破裂或泄漏
- 针帽连接到注射器
- 注射器标签上的有效期
如果在检查注射器时发现任何问题,请勿使用注射器。
2.选择和准备
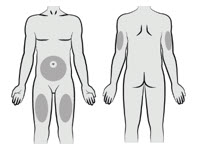
注射部位 从以下区域选择注射部位:腹部、大腿或上臂。
避免以下情况:
- 肚脐周围5厘米
- 疤痕组织或区域发红、发炎或肿胀
清洁选定的注射部位。
3.准备注射
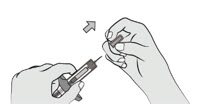
注射器 用一只手握住注射器主体。用另一只手直接拉下针帽并立即处理掉针帽。在针尖看 到一滴液体是正常的。
不要触摸针头或让它接触任何表面。
不要重新盖上注射器。
如果注射器掉落,请勿使用。
4.进行注射
捏住清洁过的皮肤。
以 45°-90° 角将针头完全插入挤压的皮肤。
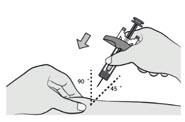
注入所有药物。
将柱塞杆推到尽可能远的位置以施用剂量并激活针头护罩。
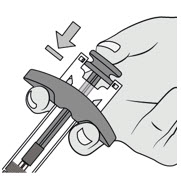
松开柱塞杆,让针头护罩盖住针头。
不要阻碍柱塞杆的运动。
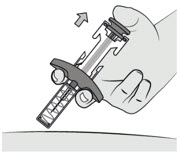
5.处置注射器
立即将用过的注射器丢弃到利器容器中。
3 剂型和规格
注射剂:25 mg/0.5 mL vutrisiran,在单剂量预装注射器中呈透明、无色至黄色溶液。
4 禁忌症
没有任何。
5 警告和注意事项
5.1 降低血清维生素 A 水平和推荐补充剂
AMVUTTRA 治疗导致血清维生素 A 水平降低[见不良反应 (6.1)和临床药理学 (12.2) ]。
建议服用 AMVUTTRA 的患者按照推荐的每日维生素 A 摄入量进行补充。在使用 AMVUTTRA 治疗期间,不应给予高于推荐的每日维生素 A 摄入量的剂量以试图达到正常的血清维生素 A 水平,因为血清维生素 A 水平不能反映体内的总维生素 A。
如果患者出现提示维生素 A 缺乏的眼部症状(例如,夜盲症),应将其转诊至眼科医生。
6 不良反应
在说明书的其他部分更详细地讨论了以下具有临床意义的不良反应:
- 降低血清维生素 A 水平和推荐补充剂[见警告和注意事项 (5.1) ]
6.1 临床试验经验
由于临床试验是在广泛不同的条件下进行的,因此在 AMVUTTRA 临床试验中观察到的不良反应率不能直接与另一种药物临床试验中的发生率进行比较,并且可能无法反映实践中观察到的发生率。
在研究 1 [见临床研究 (14) ],共有 122 名由遗传性转甲状腺素介导的淀粉样变性(hATTR 淀粉样变性)引起的多发性神经病患者接受了 AMVUTTRA。其中,118 名患者接受了至少 9 个月的治疗,34 名患者接受了至少 15 个月的治疗。平均治疗时间为 12.9 个月(范围:1.7 至 19.3 个月)。基线时患者的中位年龄为 60 岁,65% 的患者为男性。接受 AMVUTTRA 治疗的患者中有 70% 为白种人,17% 为亚洲人,3% 为黑人,9% 为其他人。44% 的患者在转甲状腺素蛋白基因中有 Val30Met 突变;其余患者有 21 种其他突变之一。在基线时,70% 的患者处于疾病的第 1 阶段,30% 的患者处于疾病的第 2 阶段。
最常见的不良反应(至少 5%)是关节痛、呼吸困难和维生素 A 减少(见表 1)。
在研究 1 中,指导患者服用推荐的每日维生素 A 摄入量[见警告和注意事项 (5.1) ]。接受 AMVUTTRA 治疗的患者中有 74% 的基线维生素 A 水平正常,而基线正常的患者中有 98% 的维生素 A 水平较低。在某些情况下,维生素 A 水平降低被报告为不良反应(见表 1)。

接受 AMVUTTRA 治疗的患者发生了 2 例房室(AV)心脏传导阻滞的严重不良反应(1.6%),其中 1 例为完全 AV 阻滞。
在接受 AMVUTTRA 治疗的 5 名 (4%) 患者中报告了注射部位反应。报告的症状包括瘀伤、红斑、疼痛、瘙痒和发热。注射部位反应轻微且短暂。
6.2 免疫原性
与所有寡核苷酸一样,具有免疫原性的潜力。抗体形成的检测高度依赖于检测的灵敏度和特异性。此外,在测定中观察到的抗体(包括中和抗体)阳性发生率可能受到多种因素的影响,包括测定方法、样品处理、样品采集时间、伴随药物和潜在疾病。由于这些原因,将下述研究中的抗体发生率与其他研究或其他产品中的抗体发生率进行比较可能会产生误导。
在研究 1 中,3 名 (2.5%) 接受 AMVUTTRA 治疗的患者产生了抗药物抗体。尽管没有发现抗药物抗体的开发会影响 AMVUTTRA 在这些患者中的药代动力学、安全性或疗效,但现有数据太有限,无法得出明确的结论。
8 在特定人群中的使用
8.1 怀孕
风险摘要
没有关于孕妇使用 AMVUTTRA 的可用数据来告知药物相关的不良发育结果风险。
AMVUTTRA 治疗导致血清维生素 A 水平降低,建议服用 AMVUTTRA 的患者补充维生素 A。
维生素 A 对正常的胚胎发育至关重要;然而,过量的维生素 A 与不利的发育影响有关。由 AMVUTTRA 引起的母体血清 TTR 降低和补充维生素 A 对胎儿的影响尚不清楚[见警告和注意事项 (5.1)和临床药理学 (12.2) ]。
在动物研究中,妊娠大鼠皮下注射vutrisiran在与母体毒性相关的剂量下会导致发育毒性(降低胎儿体重和胚胎胎儿死亡率)(见数据)。
在美国一般人群中,临床公认妊娠中重大出生缺陷和流产的估计背景风险分别为 2% 至 4% 和 15% 至 20%。指定人群的重大出生缺陷和流产的背景风险尚不清楚。
数据
动物数据
在器官形成期对妊娠大鼠皮下注射vutrisiran(0、3、10 或 30 mg/kg/天)导致高剂量的胚胎胎儿死亡和中高剂量的胎儿体重降低,这与具有母体毒性。
对怀孕兔皮下注射vutrisiran(0、3、10 或 30 mg/kg/天)对胚胎发育没有不良影响。
在整个妊娠期和哺乳期,每 6 天向妊娠大鼠皮下注射vutrisiran(0、5、10 或 20 mg/kg),对后代的发育没有不良影响。
8.2 哺乳期
风险摘要
没有关于人乳中存在vutrisiran、对母乳喂养婴儿的影响或对产奶量的影响的信息。母乳喂养的发育和健康益处应与母亲对 AMVUTTRA 的临床需求以及 AMVUTTRA 或潜在母体状况对母乳喂养婴儿的任何潜在不利影响一起考虑。
8.4 儿科使用
在儿科患者中的安全性和有效性尚未确定。
8.5 老年人使用
≥65 岁的患者无需调整剂量[见临床药理学 (12.3) ]。在研究 1 中,共有 46 名(38%)名≥65 岁的患者(包括 7 名(6%)名≥75 岁的患者)接受了 AMVUTTRA。在这些患者和年轻患者之间未观察到安全性或有效性的总体差异,但不能排除一些老年人的敏感性更高。
8.6 肾损伤
在有轻度或中度肾受损患者(估计肾小球滤过率 [eGFR] ≥30 至 <90 mL/min/1.73 m 2)中不推荐剂量调整[见临床药理学 (12.3) ]。AMVUTTRA 尚未在严重肾功能不全或终末期肾病患者中进行研究。
8.7 肝损伤
在有轻度肝受损患者(总胆红素 ≤1 × ULN 和 AST >1 × ULN,或总胆红素 >1.0 至 1.5 × ULN 和任何 AST)不推荐剂量调整[见临床药理学 (12.3) ]。AMVUTTRA 尚未在中度或重度肝受损患者中进行研究。
11 说明
AMVUTTRA 含有vutrisiran,一种化学修饰的双链小干扰核糖核酸 (siRNA),可靶向突变和野生型转甲状腺素蛋白 (TTR) 信使 RNA (mRNA),并与含有三个N-乙酰半乳糖胺 (GalNAc) 残基的配体共价连接能够将 siRNA 递送至肝细胞。vutrisiran钠的结构式如下所示。
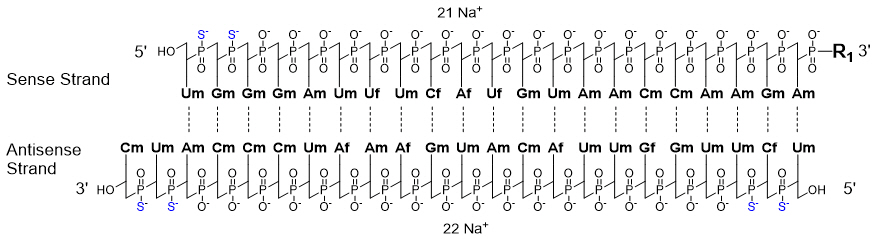


12 临床药理学
12.1 作用机制
Vutrisiran是一种双链 siRNA-GalNAc 偶联物,通过 RNA 干扰导致突变型和野生型 TTR mRNA 的降解,从而导致血清 TTR 蛋白和组织中 TTR 蛋白沉积物的减少。
12.2 药效学
在研究 1 [见临床研究 (14) ]中,每 3 个月向患有 hATTR 淀粉样变性的患者施用推荐的 AMVUTTRA 剂量后,vutrisiran将稳态时的平均血清 TTR 降低了 83%。无论 Val30Met 基因型状态、体重、性别、年龄或种族如何,都观察到类似的 TTR 降低。
Vutrisiran还在 9 个月内将平均稳态血清维生素 A 降低了 62% [见警告和注意事项 (5.1) ]。
心脏电生理学
在每三个月一次的推荐剂量 25 mg 的 12 倍剂量下,AMVUTTRA 不会将 QT 间期延长至任何临床相关程度。
12.3 药代动力学
AMVUTTRA 的药代动力学 (PK) 特性在健康受试者单次给药和 hATTR 淀粉样变性患者多次给药后进行了评估,如表 2 所示。

特定人群
根据年龄、性别、种族、轻度和中度肾功能不全(eGFR≥30 至 <90 mL/min/1.73 m 2 )或轻度肝功能不全(总胆红素 ≤1 × ULN 和 AST >1 × ULN,或总胆红素 >1.0 至 1.5 × ULN 和任何 AST)。Vutrisiran尚未在严重肾功能不全、终末期肾病、中度或重度肝功能不全的患者或既往肝移植的患者中进行过研究。
药物相互作用研究
尚未对vutrisiran进行临床药物-药物相互作用研究。体外研究表明vutrisiran不是细胞色素 P450 酶的底物或抑制剂。预计Vutrisiran不会通过诱导 CYP 酶或调节药物转运蛋白的活性来引起药物-药物相互作用。
13 非临床毒理学
13.1 致癌、突变、生育力受损
致癌作用
尚未进行vutrisiran的致癌性研究。
诱变
Vutrisiran在体外(细菌致突变性、人血外周淋巴细胞染色体畸变)和体内(大鼠骨髓微核)试验中均呈阴性。
生育力受损
在交配前和交配期间,对雄性和雌性大鼠皮下注射vutrisiran (0、15、30 或 70 mg/kg/周),并在雌性大鼠中持续至妊娠第 6 天,对生育力或生殖性能没有不良影响。
14 临床研究
在一项针对由 hATTR 淀粉样变性引起的多发性神经病成人患者进行的随机、开放标签临床试验中评估了 AMVUTTRA 的疗效(研究 1;NCT03759379)。患者以 3:1 的比例随机接受每 3 个月一次皮下注射 25 mg AMVUTTRA(N=122),或每 3 周静脉注射 0.3 mg/kg patisiran(N=42)作为参考组。97% 的 AMVUTTRA 治疗患者和 93% 的 patisiran 治疗患者完成了至少 9 个月的指定治疗。
疗效评估基于研究 1 的 AMVUTTRA 组与另一项研究 (NCT01960348) 中的外部安慰剂组的比较,该研究由可比的由 hATTR 淀粉样变性引起的多发性神经病的成年患者组成。
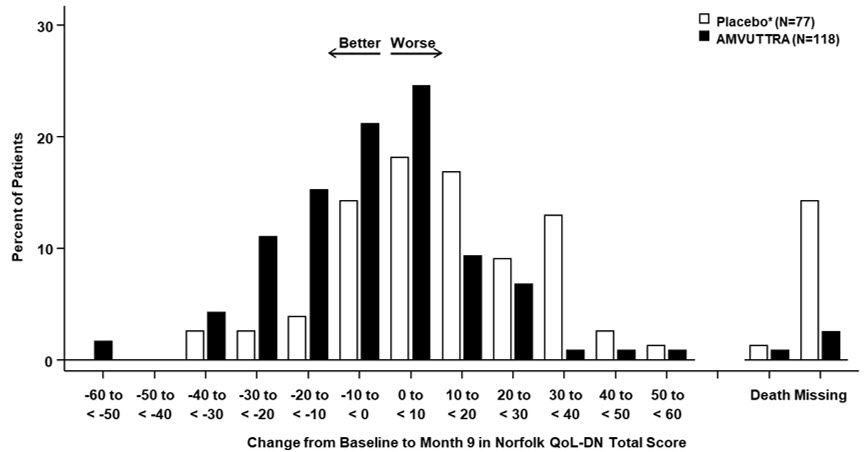
主要疗效终点是改良神经病变损伤评分+7 (mNIS+7) 从基线到第 9 个月的变化。mNIS+7 是对神经病变的客观评估,包括 NIS 和修正的 +7 综合评分。在试验中使用的 mNIS+7 版本中,NIS 客观地测量颅神经功能、肌肉力量和反射的缺陷,+7 评估体位血压、定量感觉测试和周围神经电生理学。mNIS+7 的总分范围为 0 到 304 分,分数越高代表疾病的严重程度越高。
通过诺福克生活质量-糖尿病神经病变 (QoL-DN) 总分从基线到第 9 个月的变化来评估对 mNIS+7 影响的临床意义。Norfolk QoL-DN 量表是一项患者报告的评估,用于评估以下领域的神经病变的主观体验:身体机能/大纤维神经病变、日常生活活动、症状、小纤维神经病变和自主神经病变。Norfolk QoL-DN 的总分范围为 -4 到 136,分数越高表示损伤越大。
其他终点是步态速度,通过 10 米步行测试 (10MWT) 和修正体重指数 (mBMI) 测量。


图 4:第 9 个月时诺福克 QoL-DN 总分从基线变化的直方图(研究 1 中的 AMVUTTRA 治疗与外部安慰剂对照的比较*)

16 如何提供/储存和处理
16.1 如何提供
AMVUTTRA 是一种无菌、无防腐剂、透明、无色至黄色的皮下注射溶液。AMVUTTRA 以 25 mg/0.5 mL 溶液的形式提供在单剂量 1-mL 预装注射器中,注射器由 I 型玻璃制成,带有不锈钢 29 号针头和针头护罩。预充式注射器组件不是用天然橡胶胶乳制成的。
AMVUTTRA 采用纸盒包装,每盒包含一个单剂量预装注射器。
NDC 是:71336-1003-1。
16.2 储存和处理
在 2°C 至 30°C(36°F 至 86°F)的温度下储存在原始纸箱中,直至准备好使用。不要冻结。
17 患者咨询信息
推荐的维生素 A 补充剂
告知患者 AMVUTTRA 治疗导致血清维生素 A 水平降低。指导患者服用建议的每日维生素 A 摄入量。建议患者在出现提示维生素 A 缺乏的眼部症状(例如夜盲症)时联系其医疗保健提供者,如果出现这些症状,请将其转诊给眼科医生[见警告和注意事项(5.1) ]。
怀孕
指导患者,如果他们在服用 AMVUTTRA 时怀孕或计划怀孕,他们应该通知他们的医疗保健提供者。告知患者对胎儿的潜在风险,包括 AMVUTTRA 治疗导致血清维生素 A 水平降低[见特殊人群中的使用 (8.1)和临床药理学 (12.2) ]。
为:Alnylam Pharmaceuticals, Inc., Cambridge, MA 02142 制造
AMVUTTRA 是 Alnylam Pharmaceuticals, Inc. 的未决商标。
主要显示面板 - 25 毫克注射器纸盒
国家数据中心 71336-1003-1
amvuttra ™
( vutrisiran ) 注射液
25 毫克/0.5 毫升
仅供医疗保健专业人员皮下注射
仅接收
如果密封破损,请勿使用
1 x 25 mg 单剂量
预装注射器

【备注】以上内容仅供参考,不作为用药依据,详情请参照药品附带说明书。
-
本说明书来源于:美国FDA
https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/8db0facb-81b6-4006-9239-27dc6409c5d3/spl-doc?hl=vutrisiran
温馨提醒:
①建议您用 谷歌浏览器 在电脑上或手机 打开以上链接,就可以自动翻译成简体中文,而且翻译的还比较准确。
②本说明书仅供参考,最新的说明书详见药品附带的说明书










【备注】以上内容仅供参考,不作为用药依据,详情请参照药品附带说明书。
-
搜索更多相关资讯,请进入资讯页面
